Study on Pigments in Freshwater Pearls and Hyriopsis Cumingii Based on Raman Spectra and EEM Spectra
-
摘要:
颜色是评价珍珠质量的重要因素,但其致色物质仍未有定论。在珍珠生长过程中,颜色可能受到母蚌影响。为研究二者的关联,本研究以三角帆蚌及其培育的无核珍珠样品为研究对象,使用拉曼光谱与三维荧光光谱对其进行检测分析,并运用量子化学计算色素结构的理论拉曼光谱。结果发现,不同颜色珍珠样品中多烯色素的拉曼光谱特征基本相似,都具有C=C双键伸缩振动峰与C-C单键伸缩振动峰;区别在于不同颜色珍珠的具体拉曼峰位,这是由于多烯色素的共轭链长不同导致。橙黄色珍珠与紫色珍珠样品中的多烯色素分别含有10个C=C双键和12个C=C双键;珍珠样品的颜色越深,三维荧光光谱的强度越弱, 荧光中心位置均位于284 nm/340 nm处。淡水珍珠与三角帆蚌蚌壳的拉曼光谱与三维荧光光谱特征几乎相同,说明二者成分高度相似,推测二者在生物矿化过程中色素的分泌与代谢过程非常相似。
Abstract:Colour is an important factor in evaluating the quality of pearl and directly affects its value. But definitive conclusion about the pigments of pearls has not yet been determined. During the growth process, the colour of pearl may be affected by its mussel. In order to study the relationship between pigments in pearls and mussels, Hyriopsis cumingii and its non-nucleated pearls were selected and their Raman spectra and excitation-emission matrix (EEM) spectra were collected. The theoretical Raman spectra of possible pigment structures were calculated by quantum chemistry. The results show that the Raman spectral characteristics of pearls of different colours are similar but also different. The similarity is that they all present the characteristics of polyene pigments: they all have the stretching vibration of C=C double bond and the stretching vibration of C-C single bond. While the Raman peak positions of pearls with different colour perform different. This is due to the different conjugated chain lengths of polyene pigments. The polyene pigments in orange yellow pearls and purple pearls contain 10 C=C double bonds and 12 C=C double bonds, respectively. In terms of EEM spectral characteristics, the darker the pearl colour, the weaker the fluorescence intensity. The fluorescence centers are located at 284 nm/340 nm. The Raman spectra and EEM spectra of freshwater pearls and Hyriopsis cumingii shells are almost identical, indicating a high degree of similarity in their composition. It is speculated that the secretion and metabolism of pigments in the biomineralization process of the two are very similar.
-
珍珠是一种常见的有机宝石,主要由95%~ 99%的CaCO3以及1%~5%的有机质构成[1]。碳酸钙外壳的双壳类、腹足类和头足类淡水和海水软体动物均具备分泌珍珠的能力[2],基于此,通过人工外套膜组织移植技术可在这类软体动物体内培育大量养殖珍珠。我国是淡水珍珠养殖大国,在浙江、江西、安徽等地均有珍珠养殖产业。淡水养殖珍珠常见体色有白色、橙色、紫色,其颜色和光泽直接影响价格。近年来,生物矿化产物的呈色机制研究逐渐受到广泛关注,例如,Thomas等[3]通过解析虎皮鹦鹉黄色羽毛色素组分,提出其羽毛中存在一种名为psittacofulvins的色素;Williams等[4]利用现代化学和多模态光谱技术识别出Clanculus pharaonius和C.margaritarius海蜗牛壳中两种卟啉色素。基于拉曼光谱的技术优势,该技术可以分析贝壳、天然珍珠和养殖珍珠中的色素以及矿物组成[2]。例如,胡洋等[5]通过淡水无核珍珠和海水珍珠的拉曼光谱特征,认为珍珠致色归因于多烯化合物所致;杨萧亦等[6]通过激光拉曼光谱和显微红外光谱分析,发现类胡萝卜素的共轭双键数量与淡水有核珍珠颜色之间存在一定的关系;Chen等[7-8]通过实验光谱技术与密度泛函理论计算相结合的方法,研究了淡水珍珠、孔克珠、红珊瑚等生物矿物中的色素,推测其很有可能是由多烯类色素类胡萝卜素致色。目前,淡水珍珠被广泛认为是类胡萝卜素致色。类胡萝卜素是自然界中一种常见的多烯色素,它们存在于浮游植物、钙质骨架(一些软体动物的壳)、蔬菜(胡萝卜、西红柿等)、鸟类羽毛、甚至人类视网膜的黄斑色素中[9]。而多烯色素含有一条由多个碳碳单双键交替形成的多烯链,在拉曼光谱上表现为ν1和ν2两种典型振动,1 450~1 600 cm-1内C=C双键的伸缩产生ν1振动,1 100~1 200 cm-1内C-C单键的伸缩产生ν2振动[10-11]。Stefanos等[2]通过拉曼光谱研究了珍珠与其母蚌的关系,提出了根据拉曼光谱特征溯源其珠母蚌种类的方法,进一步表明珍珠与母蚌在拉曼光谱上具有关联性和相似度。
本研究以三角帆蚌及珍珠样品为研究对象,通过拉曼光谱表征及量子化学模拟计算,研究了三角帆蚌及其珍珠样品的色素以及二者之间的关联,初步推测了其可能的多烯色素结构的理论拉曼光谱;同时运用三维荧光光谱技术对三角帆蚌及其珍珠样品的光谱学特征进行较详细表征,为进一步揭示生物矿化过程中色素分泌及其呈色机制提供一定的理论依据。
1. 样品及测试方法
1.1 实验材料
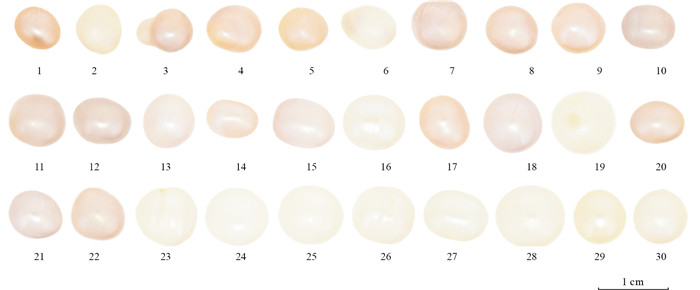
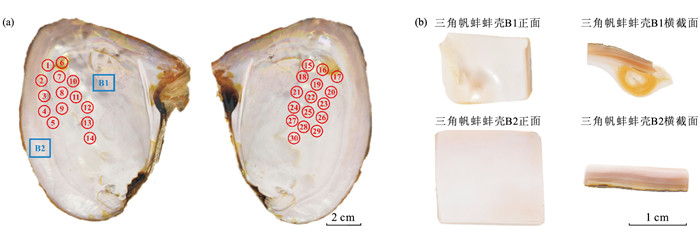
本实验选用三角帆蚌及其所产的30颗无核珍珠作为样品,三角帆蚌、珍珠的生长位置以及蚌壳研究区域如图 1所示。其中,图 1中红色圆圈代表珍珠的生长位置及样品编号(1~30),蓝色方框代表蚌壳研究区域(蚌壳内部区域B1和边缘区域B2,图 1b)。根据国家珍珠分级标准(GB/T 18781—2023)[12],珍珠的颜色是其体色、伴色及晕彩的综合特征,颜色表述以体色描述为主,伴色和晕彩描述为辅。本研究主要关注三角帆蚌及其珍珠样品中的色素组成,而体色由色素种类决定,故本文颜色主要指体色。按照国家标准对珍珠颜色进行检验:在白色背景下,采用D65光源(色温6 500 K),距离珍珠20 cm观察并记录体色且不考虑伴色及晕彩。结果显示,30颗三角帆蚌珍珠样品(图 2)的颜色较为丰富,可分为4类:第一类呈现出橙黄色-紫色的混合颜色(橙黄色为主色调,紫色为次色调),记为橙紫色;第二类是紫色-橙黄色的混合颜色(紫色为主色调,橙黄色为次色调),记为紫橙色;第三类是紫色;第四类是浅黄色。
1.2 测试方法
拉曼光谱分析使用ThermoFisher DXRTM2xi拉曼光谱仪完成,测试条件:激光源YAG,激光波长532 nm,功率15 mW,空间分辨率500 nm,光谱分辨率4 cm-1,采集时间30 s,累计扫描次数1 000次,扫描范围600~1 600 cm-1。拉曼光谱均经过基线校正与归一化处理。
三维荧光光谱分析采用日本JascoFP8500型荧光光谱仪完成,测试条件:激发光源波长范围200~500 nm,带宽5 nm,数据间隔2 nm;荧光光谱采集范围220~600 nm,带宽2.5 nm,数据间隔1 nm;检测器扫描速度1 000 nm/min,电压390 V。
本研究仅计算含有C、H的简单多烯结构的理论拉曼光谱,并与珍珠和蚌壳的实验拉曼谱峰进行对比。量子化学计算运用程序Gaussian 16完成[13],先使用泛函B3LYP搭配基组6-311G(d, p)对多烯结构进行结构优化[14],然后运用相同的泛函与基组对多烯的拉曼光谱进行计算,使用频率校正因子0.972 9对计算所得频率进行校正[15]。
2. 结果与分析
2.1 拉曼光谱分析
2.1.1 珍珠的拉曼光谱
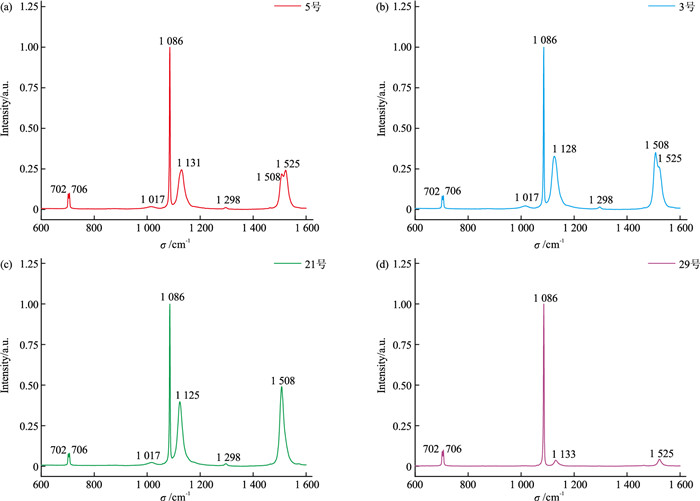
珍珠的拉曼光谱主要由无机物文石(主要化学成分为CaCO3)的特征峰与多烯类色素的特征峰构成。在文石[CO32-]基团的4个内振动模式中,ν1对称伸缩振动和ν4面内弯曲振动具有较强的拉曼活性,由ν4(C-O)反对称弯曲振动产生的一对拉曼峰位于约704 cm-1处,由ν1(C-O)对称伸缩振动产生的拉曼峰位于约1 085 cm-1处[2]。多烯类色素是自然界中常见的色素,多烯链由多个交替的C=C双键和C-C单键组成,这种结构通过共振效应可以产生非常强的拉曼信号,即使浓度很低,依然可以被拉曼光谱检测[16-17]。多烯色素在1 450~1 600 cm-1之间呈现ν1(C=C)伸缩振动,在1 100~1 200 cm-1之间呈现ν2(C-C)伸缩振动。其中ν1的位置与C=C双键的数量有关,所以通过ν1的数值可以表征多烯的链长,ν2的位置与C-C伸缩振动与C-H面内弯曲振动的耦合有关[16]。根据已有研究资料[7]显示,橙黄色珍珠中多烯色素的ν1和ν2位置分别在1 525 cm-1和1 133 cm-1附近;紫色珍珠中多烯色素的ν1和ν2位置分别在1 508 cm-1和1 125 cm-1附近。
选取上述4类代表性颜色珍珠样品进行拉曼光谱测试,其图谱及色素拉曼峰的统计结果如图 3和表 1所示。橙紫色珍珠样品5号的拉曼光谱中ν1峰位于1 525 cm-1与1 508 cm-1处,且1 525 cm-1处峰的强度高于1 508 cm-1处的(图 3a);紫橙色珍珠样品3号的拉曼光谱中ν1峰位于1 508 cm-1与1 525 cm-1处,且1 508 cm-1处峰的强度高于1 525 cm-1处的(图 3b);紫色珍珠样品21号的拉曼峰位于1 508、1 298、1 125、1 017 cm-1处(图 3c);浅黄色珍珠样品29号的多烯色素拉曼峰强度非常弱,与多烯色素有关的拉曼峰主要有1 525 cm-1与1 133 cm-1处(图 3d)。
表 1 珍珠样品中色素的拉曼峰位统计Table 1. Raman peak positions of the pigments in pearl samples样品号 色素拉曼峰位统计/cm-1 样品号 色素拉曼峰位统计/cm-1 1 1 525, 1 508, 1 298, 1 131, 1 017 16 1 525, 1 133 2 1 525, 1 508, 1 298, 1 131, 1 017 17 1 525, 1 508, 1 298, 1 128, 1 017 3 1 525, 1 508, 1 298, 1 128, 1 017 18 1 525, 1 508, 1 298, 1 128, 1 017 4 1 525, 1 508, 1 298, 1 131, 1 017 19 1 508, 1 298, 1 125, 1 017 5 1 525, 1 508, 1 298, 1 131, 1 017 20 1 525, 1 508, 1 298, 1 128, 1 017 6 1 508, 1 298, 1 125, 1 017 21 1 508, 1 298, 1 125, 1 017 7 1 508, 1 298, 1 125, 1 017 22 1 525, 1 508, 1 298, 1 128, 1 017 8 1 525, 1 508, 1 298, 1 128, 1 017 23 1 525, 1 133 9 1 525, 1 508, 1 298, 1 128, 1 017 24 1 525, 1 133 10 1 525, 1 508, 1 298, 1 128, 1 017 25 1 525, 1 133 11 1 508, 1 298, 1 125, 1 017 26 1 525, 1 508, 1 298, 1 131, 1 017 12 1 525, 1 508, 1 298, 1 128, 1 017 27 1 525, 1 133 13 1 525, 1 508, 1 298, 1 128, 1 017 28 1 525, 1 508, 1 131 14 1 525, 1 508, 1 298, 1 131, 1 017 29 1 525, 1 133 15 1 525, 1 508, 1 298, 1 128, 1 017 30 1 525, 1 508, 1 131 2.1.2 三角帆蚌的拉曼光谱
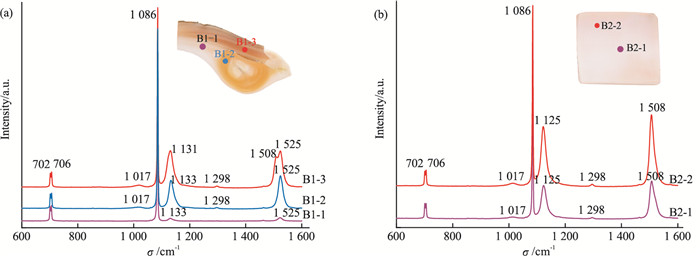
通过肉眼观察发现,三角帆蚌蚌壳与其所产珍珠的颜色特征高度相似。珍珠中的色素种类可能与三角帆蚌蚌壳的色素种类有着非常紧密的关联。基于此,本研究收集了代表性三角帆蚌蚌壳研究区域(B1和B2)的拉曼光谱(图 4),每个区域测试2~3个点位。
蚌壳测试点B1-1来自浅黄色位置,其多烯色素的拉曼峰主要位于1 525 cm-1与1 133 cm-1处,其他色素峰由于强度过低而不容易被观察到;测试点B1-2来自橙黄色位置,其多烯色素的拉曼峰主要位于1 525、1 298、1 133、1 017 cm-1处;测试点B1-3来自橙黄色-紫色混合颜色位置,其多烯色素的拉曼峰主要有1 525、1 508、1 298、1 131、1 017 cm-1。上述蚌壳中多烯色素的拉曼峰与其对应颜色的珍珠样品的拉曼光谱完全一致(图 4a)。蚌壳测试点B2-1为浅紫色位置以及B2-2来自紫色位置,这两处的拉曼峰位置基本相同,仅强度略不同,其多烯色素的拉曼峰主要位于1 508、1 298、1 125、1 017 cm-1处(图 4b),与紫色珍珠样品的拉曼光谱一致。综上,淡水无核养殖珍珠中出现的多烯色素同样也存在于三角帆蚌蚌壳中。
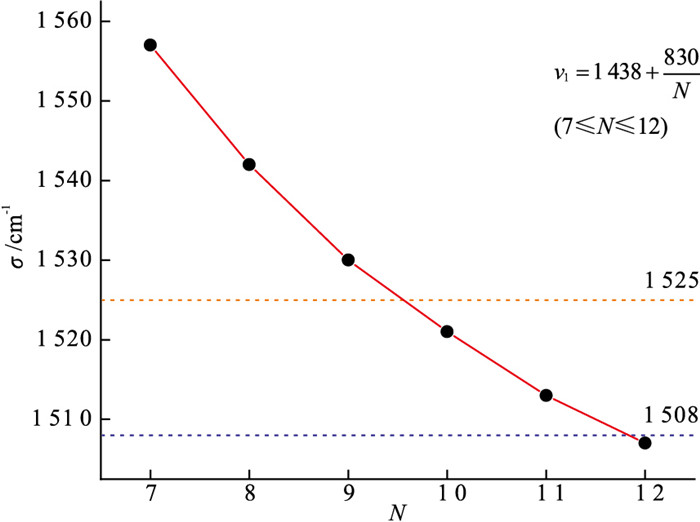
前人对多烯链长与多烯的ν1(C=C)伸缩振动拉曼峰的关系进行了研究,发现该拉曼峰的位置与多烯链的C=C双键的个数有关[18-19]。其中比较经典的公式为$\nu_1=1438+\frac{830}{N} $(7≤N≤12),公式中N为C=C双键的个数,结合本文橙色珍珠样品的ν1拉曼峰(1 525 cm-1) 与紫色珍珠样品的ν1拉曼峰(1 508 cm-1)的位置,将这些数据转化为图 5。结果显示,不同的色素链长导致了珍珠的不同颜色,橙色与紫色珍珠的颜色分别是由含有10个C=C双键的多烯色素与含有12个C=C双键的多烯色素导致。
2.1.3 多烯色素的理论拉曼光谱
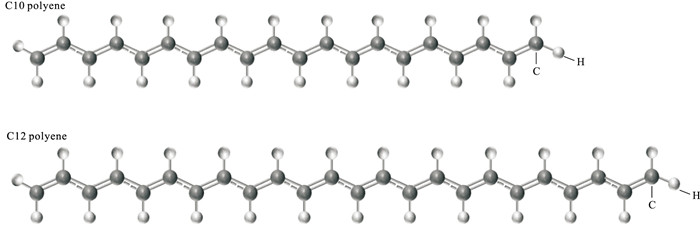
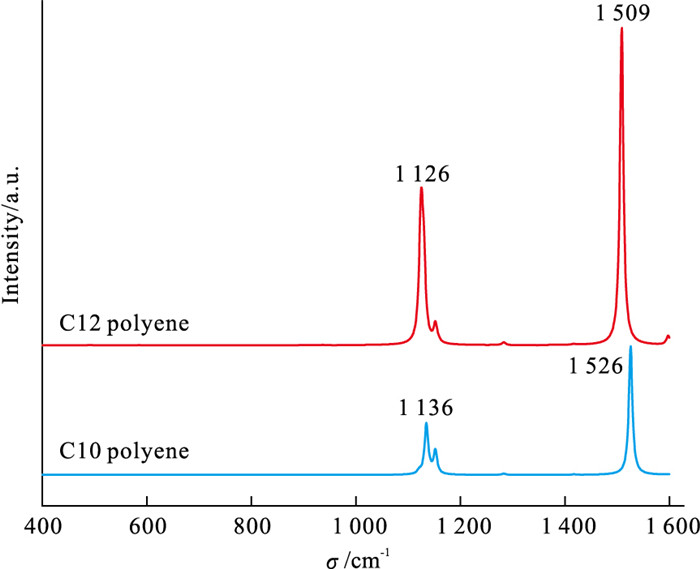
通过上述分析,本研究初步认为珍珠样品的橙色色素与紫色色素的基本结构分别是含有10个C=C双键的多烯和含有12个C=C双键的多烯(简称为C10多烯链与C12多烯链)。为进一步验证,笔者选取结构最简单的多烯结构(仅含C和H),如图 6所示,并运用量子化学的方法计算这些多烯链的理论拉曼光谱(图 7),不同颜色珍珠的实验拉曼谱峰与对应的不同链长多烯的理论拉曼谱峰对比如表 2所示。
表 2 珍珠的实验拉曼谱峰与多烯的理论拉曼谱峰对比(ν1和ν2)Table 2. Comparison of the experimental Raman peaks of the pearls and the theoretical Raman peaks of the polyene (ν1 and ν2)/cm-1 珍珠颜色 实验值ν1 实验值ν2 多烯双键数 理论值ν1 理论值ν2 橙黄色 1 525 1 133 10 1 526 1 136 紫色 1 508 1 125 12 1 509 1 126 根据图 7与表 2显示,不同颜色珍珠样品的主要实验拉曼谱峰(ν1和ν2)与对应不同链长的多烯的理论拉曼谱峰(ν1和ν2)非常接近,进一步揭示了不同颜色的珍珠中多烯色素的链长。同时,珍珠的拉曼光谱与蚌壳的拉曼光谱特征几乎一致,以此类推,蚌壳色素的基本结构分别是C10多烯链与C12多烯链。
2.2 三维荧光光谱分析
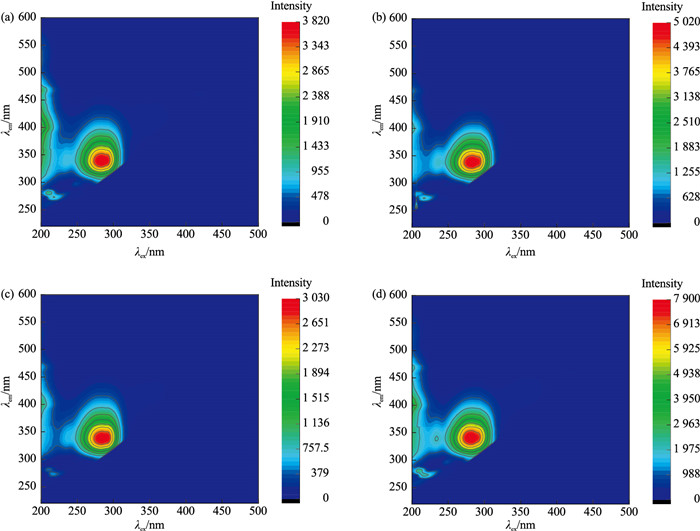
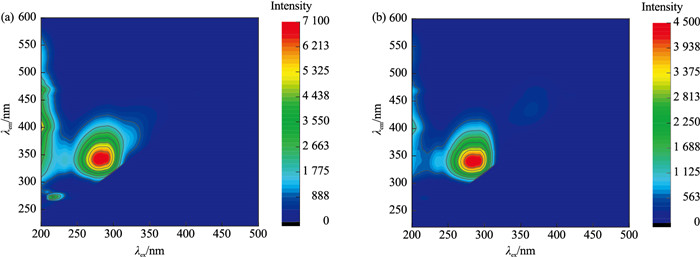
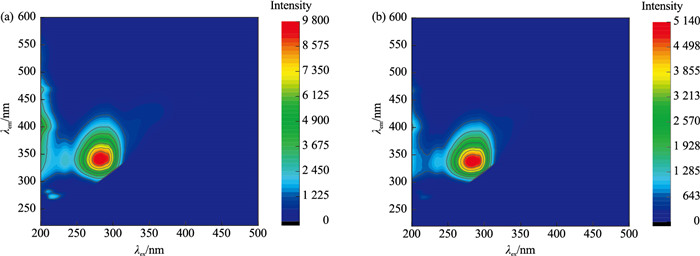
三维荧光光谱技术是近年发展起来的一门新的荧光分析技术,在有机物分析领域已经有了很多应用。基于此,笔者尝试运用三维荧光光谱技术去表征不同颜色的珍珠与蚌壳。选取具有代表性的橙紫色珍珠样品5号、紫橙色珍珠样品3号、紫色珍珠样品21号以及浅黄色珍珠样品29号进行测试,其三维荧光光谱如图 8所示,蚌壳B1正面与横截面的三维荧光光谱如图 9所示,蚌壳B2正面与横截面的三维荧光光谱如图 10所示。
本文将最强荧光峰数组,激发波长(λex)/发射波长(λem)简称为荧光中心。从图 8可以发现,不同颜色珍珠样品的三维荧光光谱特征几乎完全一致,荧光中心位置均位于284 nm/340 nm处,珍珠颜色越浅,荧光强度越强。三角帆蚌蚌壳不同位置的三维荧光光谱特征几乎完全一致,正面和横截面的荧光中心均位于284 nm/340 nm处(图 9和图 10),蚌壳颜色越浅,荧光强度越强。与此同时,蚌壳与其所产珍珠的三维荧光光谱特征几乎完全一致。三维荧光是表征大分子有机物的重要手段,据此推测珍珠与三角帆蚌中的有机物非常接近。
3. 讨论
通过比较珍珠与三角帆蚌样品的拉曼光谱发现,它们的文石峰及多烯色素的主要特征峰基本相同,多烯色素在1 500~1 550 cm-1之间呈现出ν1(C=C)伸缩振动,在1 100~1 150 cm-1之间呈现出ν2(C-C)伸缩振动。珍珠与三角帆蚌蚌壳的三维荧光光谱特征高度相似,推测二者所含的有机物非常接近。使用拉曼光谱研究珍珠与蚌壳中的多烯色素结构,主要是依靠光谱特征对多烯色素的基本结构(链长)进行推测,为之后解析色素结构提供理论依据。但对于具体色素结构的解析并不能仅依靠拉曼光谱,需要结合分析化学的方法来对色素进行有效提取,运用液相色谱-质谱联用技术对色素结构进行更精确解析。
4. 结论
(1) 拉曼光谱测试结果显示,三角帆蚌橙黄色珍珠样品的主要色素峰位于1 525 cm-1(ν1)和1 133 cm-1(ν2)处,紫色珍珠样品的主要色素峰位于1 508 cm-1(ν1)和1 125 cm-1(ν2)处,橙黄色-紫色混合色珍珠表现出二者的混合特征。随着三角帆蚌淡水珍珠样品颜色加深,多烯色素拉曼峰的相对强度逐渐增强。结合珍珠样品的拉曼光谱与由量子化学模拟得到多烯的理论拉曼光谱认为,橙黄色珍珠与紫色珍珠样品中的多烯色素分别含有10个C=C双键和12个C=C双键。三角帆蚌淡水珍珠为多烯色素致色,但不同颜色珍珠的多烯色素含量不同。
(2) 三角帆蚌蚌壳样品的拉曼光谱特征与淡水珍珠一致,二者的色素成分几乎相同,推测在生物矿化的过程二者的色素分泌累积过程非常相似。
(3) 淡水珍珠与三角帆蚌蚌壳样品的三维荧光光谱特征基本一致,推测珍珠中的化学成分与三角帆蚌蚌壳中的化学成分非常相似。
三角帆蚌与珍珠在生物矿化过程中色素的分泌与代谢过程非常相似,该研究对后续研究三角帆蚌中色素的分泌与代谢与如何影响珍珠颜色具有一定理论意义。
致谢: 中国地质大学(武汉)珠宝学院杨明星教授在实验过程中提供有帮助的建议,在此表示感谢。 -
表 1 珍珠样品中色素的拉曼峰位统计
Table 1 Raman peak positions of the pigments in pearl samples
样品号 色素拉曼峰位统计/cm-1 样品号 色素拉曼峰位统计/cm-1 1 1 525, 1 508, 1 298, 1 131, 1 017 16 1 525, 1 133 2 1 525, 1 508, 1 298, 1 131, 1 017 17 1 525, 1 508, 1 298, 1 128, 1 017 3 1 525, 1 508, 1 298, 1 128, 1 017 18 1 525, 1 508, 1 298, 1 128, 1 017 4 1 525, 1 508, 1 298, 1 131, 1 017 19 1 508, 1 298, 1 125, 1 017 5 1 525, 1 508, 1 298, 1 131, 1 017 20 1 525, 1 508, 1 298, 1 128, 1 017 6 1 508, 1 298, 1 125, 1 017 21 1 508, 1 298, 1 125, 1 017 7 1 508, 1 298, 1 125, 1 017 22 1 525, 1 508, 1 298, 1 128, 1 017 8 1 525, 1 508, 1 298, 1 128, 1 017 23 1 525, 1 133 9 1 525, 1 508, 1 298, 1 128, 1 017 24 1 525, 1 133 10 1 525, 1 508, 1 298, 1 128, 1 017 25 1 525, 1 133 11 1 508, 1 298, 1 125, 1 017 26 1 525, 1 508, 1 298, 1 131, 1 017 12 1 525, 1 508, 1 298, 1 128, 1 017 27 1 525, 1 133 13 1 525, 1 508, 1 298, 1 128, 1 017 28 1 525, 1 508, 1 131 14 1 525, 1 508, 1 298, 1 131, 1 017 29 1 525, 1 133 15 1 525, 1 508, 1 298, 1 128, 1 017 30 1 525, 1 508, 1 131 表 2 珍珠的实验拉曼谱峰与多烯的理论拉曼谱峰对比(ν1和ν2)
Table 2 Comparison of the experimental Raman peaks of the pearls and the theoretical Raman peaks of the polyene (ν1 and ν2)
/cm-1 珍珠颜色 实验值ν1 实验值ν2 多烯双键数 理论值ν1 理论值ν2 橙黄色 1 525 1 133 10 1 526 1 136 紫色 1 508 1 125 12 1 509 1 126 -
[1] 李立平. 海水及淡水养殖珍珠的物质组成[J]. 地球科学, 2009, 34(5): 752-758. doi: 10.3321/j.issn:1000-2383.2009.05.005 Li L P. Composition of seawater and freshwater cultured pearls[J]. Earth Science, 2009, 34(5): 752-758. (in Chinese) doi: 10.3321/j.issn:1000-2383.2009.05.005
[2] Karampelas S, Fritsch E, Makhlooq F, et al. Raman spectroscopy of natural and cultured pearls and pearl producing mollusc shells[J]. Journal of Raman Spectroscopy, 2020(51): 1 813-1 821.
[3] Cooke T F, Fischer C R, Wu P, et al. Genetic mapping and biochemical basis of yellow feather pigmentation in Budgerigars[J]. Cell, 2017, 171(2): 427-439. doi: 10.1016/j.cell.2017.08.016
[4] Williams S T, Ito S, Wakamatsu K, et al. Identification of shell colour pigments in marine snails Clanculus pharaonius and C. margaritarius (Trochoidea; Gastropoda)[J]. Plos One, 2016, 11(7): e0156664. doi: 10.1371/journal.pone.0156664
[5] 胡洋, 范陆薇, 黄艺兰. 彩色珍珠致色成分的拉曼光谱研究[J]. 光谱学与光谱分, 2014, 34(1): 98-102. Hu Y, Fan L W, Huang Y L. Research on Raman spectra of organic ingredients on colored pearls[J]. Spectroscopy and Spectral Analysis, 2014, 34(1): 98-102. (in Chinese)
[6] 杨萧亦, 周征宇, 戚筱曼, 等. 淡水有核珍珠拉曼光谱特征及致色机理探讨[J]. 激光与光电子学进展, 2021, 58(24): 514-520. Yang X Y, Zhou Z Y, Qi X M, et al. Raman spectrum characteristics and coloration mechanism of freshwater nucleated pearls[J]. Laser & Optoelectronics Progress, 2021, 58(24): 514-520. (in Chinese)
[7] Chen C, Yu J, Zhang C, et al. Nature of pigments in orange and purple coloured Chinese freshwater cultured pearls: Insights from experimental Raman spectroscopy and DFT calculations[J]. Minerals, 2023, 13(7): 959. doi: 10.3390/min13070959
[8] Chen C, Yu J, Ye X, et al. Deciphering the color origin of pink conch pearl using nondestructive spectroscopies and DFT calculations[J]. Minerals, 2023, 13(6): 811. doi: 10.3390/min13060811
[9] Karampelas S, Fritsch E, Mevellec J Y, et al. Determination by Raman scattering of the nature of pigments in cultured freshwater pearls from the mollusk Hyriopsis cumingii[J]. Journal of Raman Spectroscopy, 2007(38): 217-230.
[10] Rafaella F F, Lenize F M, Mara R C C, et al. Raman spectroscopy as a tool in differentiating conjugated polyenes from synthetic and natural sources[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2015(134): 434-441.
[11] Soldati A L, Jacob D E, Wehrmeister U, et al. Structural characterization and chemical composition of aragonite and vaterite in freshwater cultured pearls[J]. Mineralogical Magazine, 2008, 722(2): 577-590.
[12] 陆东农, 陶金波, 曹华松, 等. GB/T 18781-2023珍珠分级[S]. 北京: 中国标准出版社, 2023. Lu D N, Tao J B, Cao H S, et al. GB/T 18781-2008 Cultured pearl grading[S]. Beijing: Standards Press of China, 2008. (in Chinese)
[13] Frisch M, Trucks G, Schlegel H, et al. Gaussian 16, Revision C. 01 [EB/OL]. [2024-05-20]. http://gaussian.com/gaussian16/.
[14] Stephens P J, Devlin F J, Chabalowski C F, et al. Ab initio calculation of vibrational absorption and circular dichroism spectra using density functional force fields[J]. Journal of Physical Chemistry, 1994(98): 11 623-11 627.
[15] Kashinski D O, Chase G M, Nelson R G, et al. Harmonic vibrational frequencies: Approximate global scaling factors for TPSS, M06, and M11 functional families using several common basis sets[J]. Journal of Physical Chemistry. A, 2017(121): 2 265-2 273.
[16] Llansola-Portoles M J, Pascal A A, Robert B. Electronic and vibrational properties of carotenoids: From in vitro to in vivo[J]. Journal of the Royal Society Interface, 2017, 14(135): 20 170 504. doi: 10.1098/rsif.2017.0504
[17] Bergamonti L, Bersani D, Mantovan S, et al. Micro-Raman investigation of pigments and carbonate phases in corals and molluscan shells[J]. European Journal of Mineralogy, 2013, 25(5): 845-853.
[18] Tommasini M, Longhi G, Abbate S, et al. Theoretical investigation and computational evaluation of overtone and combination features in resonance Raman spectra of polyenes and carotenoids[J]. Journal of Raman Spectroscopy, 2014, 45(1): 89-96. doi: 10.1002/jrs.4415
[19] Schaffer H E, Chance R R, Silbey R J, et al. Conjugation length dependence of Raman scattering in a series of linear polyenes: Implications for polyacetylene[J]. Journal of Chemical Physics, 1991, 94(6): 4 161-4 170. doi: 10.1063/1.460649



 下载:
下载: